新葡的京集团3512vip首页生物合成化学团队长期从事喜树中功能酶元件发掘与表征。喜树为中国特有药用植物,自从其中发现抗癌药物喜树碱以来备受关注。除具有抗癌活性生物碱生产能力外,该植物同样富产黄酮类成分。团队前期通过靶向代谢组学的方法,从喜树中发掘并鉴定了64种黄酮类成分,并构建了喜树黄酮类成分合成代谢图谱(Syn.Syst.Biotechno., 2022,7,824-836.)。根据化学结构特征,我们发现其中有16种黄酮醇(FOL1-FOL16),其中有6种黄酮醇均以单甲基化或双甲基化的形式存在。这些甲基化修饰位点集中分布在黄酮醇骨架的C3’、C4’、C5’、C7-OH。由此,我们确认在该植物中存有负责黄酮醇C3’、C4’、C5’、C7-OH位置特异性修饰的O-甲基转移酶元件。截至目前为止,仅有10余种黄酮醇O-甲基转移酶(FOMT)被报道,且它们大多具有单位点甲基化活性(3/7/3’/4’/5’-OH),仅有一种CdFOMT5具有槲皮素的3+3’+5+7-OH多位点甲基化能力。
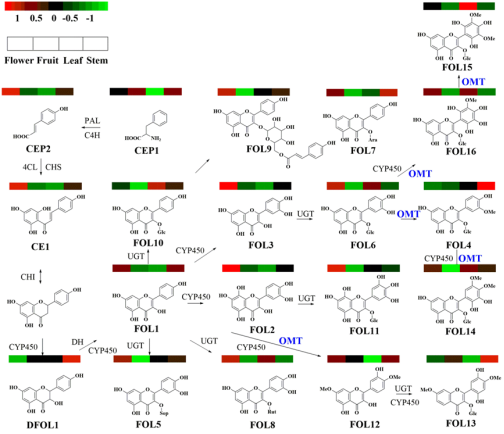
团队基于前期构建的喜树多组学数据库(ACS Chem.Biol.2023,18,1772-1785),启动了以FOMT为目标的定向发掘。我们从库中共发掘出CaFOMT候选序列55条,通过团队前期建立的筛选策略快速将目标范围缩小至2条,分别将其命名为CaFOMT1和CaFOMT2。随后分别以槲皮素、儿茶素、金雀异黄酮、10-羟基喜树碱为底物,进行了2条CaFOMT重组蛋白的活性测试与产物结构表征。结果发现,CaFOMT1对槲皮素具有严格的底物特异性和催化位点选择性,只有4’-OH可以被选择性地甲基化,将槲皮素转化为柽柳黄素。让人意外地是,CaFOMT2对槲皮素的4’-OH和7-OH具有连续的甲基化修饰能力,能将槲皮素转化为商陆素。动力学分析表明,CaFOMT1对甲基供体SAM的底物亲和力和催化性能优于底物槲皮素,而CaFOMT2对单甲基化中间体柽柳黄素呈现出更优的底物亲和力和催化性能。这两条基因均在喜树叶和根中富集表达。通过烟草瞬时表达实验确定它们在烟草体内同样呈现上述活性。
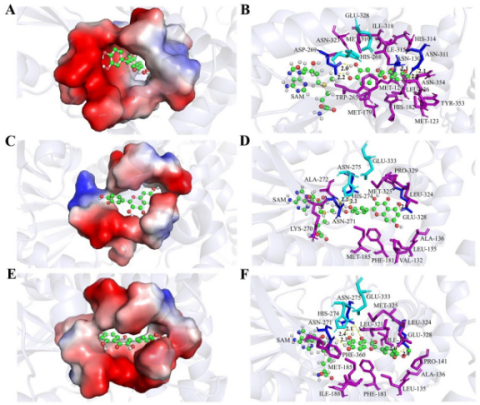
团队通过分子对接与定点突变实验发现,CaFOMT1和CaFOMT2中的酸/碱催化二联体Glu328-His268和Glu333-His274负责黄酮醇底物亲核基团的活化,以加速甲基化进程。CaFOMT1中的ASN-130、ASP-269、ASN-311和CaFOMT2中的ASN-271、ASN-275、E328氨基酸残基则与黄酮醇形成氢键以锚定底物方向,确保甲基供体与黄酮醇底物中的亲核羟基位于最佳反应距离(CaFOMT1:3.4 Å;CaFOMT2:3.1 Å和3.2 Å)。CaFOMT1的底物结合口袋由18个氨基酸组成,其紧密和狭窄的结构确保了CaFOMT1对于槲皮素底物严格的底物专一性。而CaFOMT2的底物结合口袋则由15个氨基酸组成,其口袋结构更为宽松,由此导致黄酮醇底物可以两种不同朝向与其进行结合,因而可发生4’-OH和7-OH两个不同位点的甲基化。虽然两种朝向均通过ASN-271、ASN-275、E328氨基酸残基形成氢键,但CaFOMT2-柽柳黄素复合物的结合力更强,因此CaFOMT2对于柽柳黄素的催化性能优于槲皮素。此外,我们还发现了CaFOMT2中位于底物结合口袋底部的PHE-181和MET-185位点为决定其底物选择性的关键位点。
本研究从喜树中新发现了2条具有黄酮醇甲基化修饰能力的FOMT酶元件,还从蛋白结构层面解析了2种CaFOMT的底物结合口袋,拓宽了我们对于喜树中黄酮醇合成代谢的研究认知。该研究由新葡的京集团3512vip首页生物资源化学专业研究生张家华和生物与医药专业研究生何金蔚协作完成,蒲祥副教授为论文通讯作者。本研究由国家级大学生创新训练计划项目、国家自然科学基金、四川省科技厅中央引导地方科技发展项目和四川省自然科学青年科学基金项目联合资助,研究结果以题为《Discovery of a novel flavonol O-methyltransferase possessing sequential 4′- and 7-O-methyltransferase activity from Camptotheca acuminata Decne》在生物大分子领域权威期刊《International Journal of Biological Macromolecules》发表。
文章链接:https://doi.org/10.1016/j.ijbiomac.2024.131381